製品Q&A
製剤に関する項目
A:
ケレンディア錠の開放状態での安定性試験(苛酷試験)において、キセノンランプ13時間照射*(光)、40℃・75%RHで3ヶ月(湿度)の各条件下で規格内であったことが確認されています。[1]
*総照度139万lx・hr、総近紫外放射エネルギー707W・h/m2照射
◆◆参考文献◆◆
[1]ケレンディア錠インタビューフォーム(第7版)/Ⅳ.製剤に関する項目6.製剤の各種条件下における安定性
A:
自動錠剤分包機を用いて一包化した時の薬剤の状態を検討したデータがあります。[1]
気密保存又は高湿度条件下(25℃/75%RH)で3ヵ月保存し吸湿させたケレンディア錠10mg、20mgについて、各300錠を自動錠剤分包機2機種(タカゾノ製 Eser HP-128HS-GP、湯山製作所製PROUD)で一包化し、その際のカセット内詰まり・異音等と錠剤の割れ・欠け等の破損を評価した結果、いずれの保管条件でもカセット内での錠剤の詰まり・異音等はなく、一包化の過程で錠剤の割れ・欠け等は認められませんでした。
また、ケレンディア錠の開放状態での安定性試験(苛酷試験)において、キセノンランプ13時間照射(光)、40℃・75%RHで3ヶ月(湿度)の条件下で規格内であったことが確認されています。[2]
なお、すべての分包機や保存条件を保証するものではない点にはご留意ください。
◆◆参考文献◆◆
[1]ケレンディア錠インタビューフォーム(第7版)/Ⅳ.製剤に関する項目6.製剤の各種条件下における安定性
[2]ケレンディア錠インタビューフォーム(第7版)/Ⅳ.製剤に関する項目12.その他
治療
A:
「効能又は効果」は「2型糖尿病を合併する慢性腎臓病ただし、末期腎不全又は透析施行中の患者を除く。」及び「慢性心不全
ただし、慢性心不全の標準的な治療を受けている患者に限る。」です。[1]
【参考情報】
電子添文 5.効能又は効果に関連する注意
<2型糖尿病を合併する慢性腎臓病>
5.1 アンジオテンシン変換酵素阻害薬又はアンジオテンシンⅡ受容体拮抗薬による治療が適さない場合を除き、これらの薬剤が投与されている患者に投与すること。
5.2 本剤投与によりeGFR が低下することがあることから、eGFR が25mL/min/1.73m2未満の患者には、リスクとベネフィットを考慮した上で、本剤投与の適否を慎重に判断すること。
5.3 日本人部分集団では、国際共同第Ⅲ相試験(試験16244)の主要評価項目の腎複合エンドポイントにおいて、本剤のプラセボに対するハザード比は0.911であった一方で、国際共同第Ⅲ相試験(試験16244)の主要評価項目の構成要素の腎不全、及び国際共同第Ⅲ相試験(試験17530)の副次評価項目の腎複合エンドポイントにおいては、本剤のプラセボに対するハザード比が1を上回った。試験の対象となった全体集団と比べて日本人では本剤の腎不全への進展抑制効果が弱い可能性がある。
5.4 「17.臨床成績」の項の内容を熟知し、臨床試験に組み入れられた患者の背景(原疾患、併用薬、腎機能、アルブミン尿等)を十分に理解した上で、適応患者を選択すること。
<慢性心不全>
5.5 左室駆出率の低下した慢性心不全における本剤の有効性及び安全性は確立していないため、左室駆出率の保たれた又は軽度低下した慢性心不全患者に投与すること。
5.6 「17.臨床成績」の項の内容を熟知し、臨床試験に組み入れられた患者の背景(前治療、左室駆出率、腎機能等)を十分に理解した上で、適応患者を選択すること。
◆◆参考文献◆◆
[1]ケレンディア錠電子添文(第7版)/4.効能又は効果、5.効能又は効果に関連する注意の項
A:
「用法及び用量」は以下の通りです。[1]
<2型糖尿病を合併する慢性腎臓病>
通常、成人にはフィネレノンとして以下の用量を1日1回経口投与する。
eGFRが60mL/min/1.73m2以上:20mg
eGFRが60mL/min/1.73m2未満:10mgから投与を開始し、血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に20mgへ増量する。
<慢性心不全>
通常、成人にはフィネレノンとして以下の用量を1日1回経口投与する。
eGFRが60mL/min/1.73m2以上:20mgから投与を開始し、血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に40mgへ増量する。
eGFRが25mL/min/1.73m2以上60mL/min/1.73m2未満:10mgから投与を開始し、血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に20mgへ増量する。
【参考情報】
電子添文 7.用法及び用量に関連する注意
<効能共通>
7.1 10mg錠と20mg錠の生物学的同等性は示されていないため、20mg又は40mgを投与する際には10mg錠を使用しないこと。
<2型糖尿病を合併する慢性腎臓病>
7.2 投与開始又は再開、増量から4週間後、その後も定期的に血清カリウム値及びeGFRを測定し、表に従って用量を調節すること。
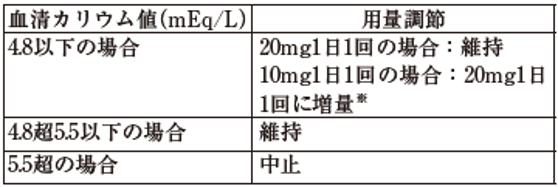
※:eGFRが前回の測定から30%を超えて低下していない場合に限る。
投与中止後、血清カリウム値が5.0mEq/L以下に下がった場合には、10mgを1日1回から投与を再開することができる。
<慢性心不全>
7.3 投与開始又は再開、用量調節から4週間後、その後も定期的に血清カリウム値及びeGFRを測定し、表に従って用量を調節すること。
投与開始時のeGFRが60mL/min/1.73m2以上の患者
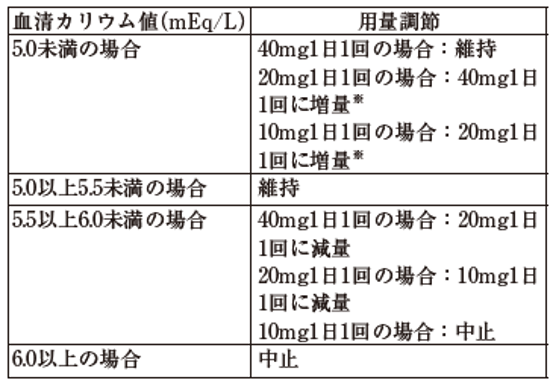
投与開始時のeGFRが25mL/min/1.73m2以上60mL/min/1.73m2未満の患者
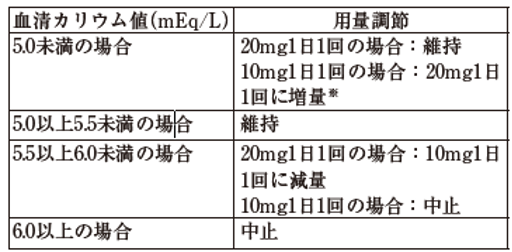
※:eGFRが前回の測定から30%を超えて低下していない場合に限る。
投与中止後、血清カリウム値が5.5mEq/L未満に下がった場合には、10mgを1日1回から再開することができる。ただし、血清カリウム値が6.0mEq/L以上で投与中止となり、投与中止後も連続して血清カリウム値が5.5mEq/L以上の患者では投与中止を継続し、血清カリウム値が5.0mEq/L未満に下がった場合に、10mgを1日1回から再開することができる。
◆◆参考文献◆◆
[1]ケレンディア錠電子添文(第7版)/6.用法及び用量、7.用法及び用量に関連する注意の項
A:
気がついた時に、1回分を飲んでください。ただし、次の飲む時間が近い場合は1回とばして、次の時間に1回分を飲んでください。[1]
決して2回分を一度に飲まないでください。
◆◆参考文献◆◆
[1]ケレンディア錠患者向医薬品ガイド
A:
1日1回服用してください。[1]
服用する時間帯や食事のタイミングの制限はありませんが、飲み忘れないことが重要ですので患者さんの生活スタイルや併用薬の服薬状況などに応じてご判断ください。
◆◆参考文献◆◆
[1]ケレンディア錠患者向医薬品ガイド
薬効薬理・薬物動態
A:
ケレンディア錠の有効成分であるフィネレノンは非ステロイド型選択的ミネラルコルチコイド受容体(MR)拮抗薬です。MRに結合することで、心臓や腎臓において炎症、線維化等を引き起こすMRの過剰活性化を抑制し、心臓及び腎臓障害の発症や進展抑制に寄与すると考えられます。[1]
◆◆参考文献◆◆
[1]ケレンディア錠インタビューフォーム(第7版)/Ⅵ.薬効薬理に関する項目2.薬理作用(1)作用部位・作用機序
A:
ケレンディア錠は小腸及び肝臓において初回通過効果を受けます。[1]
経口投与時の絶対的バイオアベイラビリティは44%です。[2]
【参考情報】
電子添文
16.2.1 バイオアベイラビリティ
健康成人被験者15例にフィネレノン5mg注)を空腹時に単回経口投与したときの絶対的バイオアベイラビリティは44%であった(外国人データ)。
注)承認された用法及び用量は、eGFRが60mL/min/1.73m2以上は20mg1日1回経口投与、eGFRが60mL/min/1.73m2未満は10mg1日1回経口投与から開始し血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に20mgへ増量である。
◆◆参考文献◆◆
[1]ケレンディア錠インタビューフォーム(第7版)/Ⅶ.薬物動態に関する項目6.代謝
[2]ケレンディア錠電子添文(第7版)/16.2.1バイオアベイラビリティの項
A:
ケレンディアは主に肝臓及び小腸(初回通過効果)においてCYP3A4により代謝され、CYP2C8の寄与も認められています。主代謝物には薬理活性はありません。[1]
排泄経路は尿中排泄が約80%、糞中排泄が約20%であり、ほとんどが代謝物として排泄され、未変化体としての排泄率は投与量の約1%です。[2]
◆◆参考文献◆◆
[1]ケレンディア錠インタビューフォーム(第7版)/Ⅶ.薬物動態に関する項目6.代謝
[2]ケレンディア錠電子添文(第7版)/16.4代謝、16.5排泄の項
安全性(特殊患者を含む)
A:
<2型糖尿病を合併する慢性腎臓病>
末期腎不全又は透析施行中の患者さんには投与しないでください。
本剤投与によりeGFRが低下することがあるため、eGFRが25mL/min/1.73m2未満の患者さんには投与の適否を慎重に判断してください。また、本剤投与中に末期腎不全又は透析に至った場合は投与を中止してください。
本剤の「用法及び用量」は以下の通りです。
通常、成人にはフィネレノンとして以下の用量を1日1回経口投与する。
eGFRが60mL/min/1.73m2以上:20mg
eGFRが60mL/min/1.73m2未満:10mgから投与を開始し、血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に20mgへ増量する。
<慢性心不全>
本剤投与開始時にeGFRが25mL/min/1.73m2未満の患者さんには投与しないでください。
本剤投与中にeGFRが25mL/min/1.73m2未満に低下した場合は、本剤の投与中止を考慮してください。また、本剤投与中に末期腎不全又は透析に至った場合は投与を中止してください。
本剤の「用法及び用量」は以下の通りです。
通常、成人にはフィネレノンとして以下の用量を1日1回経口投与する。
eGFRが60mL/min/1.73m2以上:20mgから投与を開始し、血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に40mgへ増量する。
eGFRが25mL/min/1.73m2以上:60mL/min/1.73m2未満:10mgから投与を開始し、血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に20mgへ増量する。
◆◆参考文献◆◆
[1]ケレンディア錠電子添文(第7版)/2.禁忌、5.効能又は効果に関連する注意、6.用法及び用量、9.2腎機能障害患者の項
A:
中等度~重度の肝機能障害のある患者さんでは本剤の血中濃度が上昇し、それに伴って血清カリウム値が上昇するおそれがあります。[1]
・重度(Child-Pugh分類C)の肝機能障害がある患者さんには投与しないでください(投与禁忌)。
・中等度の肝機能障害(Child-Pugh分類B)のある患者さんに投与する際には、状態に応じてより頻回に血清カリウム値を測定してください。
◆◆参考文献◆◆
[1]ケレンディア錠電子添文(第7版)/2.禁忌、9.3肝機能障害患者および16.薬物動態の項
A:
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与してください。[1]
また、授乳中の女性に投与する際には、授乳を避けてください。[2]
【参考情報】
①妊娠中の投与について[1]
動物実験(ラット)において、催奇形性(重複大動脈弓)がヒト(40mg1日1回投与)の約10倍、胚・胎児毒性(胎児体重の減少)が約7倍、受胎能への影響として黄体数、着床数の減少及び初期胚発生への影響(着床後死亡数の増加及び生存胎児数の減少)が約9倍、卵巣重量の低値が約7倍の全身暴露量で、また妊娠中の曝露によると考えられる出生児の軽度自発運動量増加がヒトの約4倍の母動物への全身曝露量で認められています。
②授乳中の投与について[2]
動物実験(ラット、静脈内投与)で乳汁中へ移行することが報告されています。また、ラットの母動物においてヒト(40mg1日1回投与)の約2倍の全身曝露量で、授乳期の児に明らかな有害作用(死亡率の増加)が認められています。
◆◆参考文献◆◆
[1]ケレンディア錠電子添文(第7版)/9.5妊婦の項
[2]ケレンディア錠電子添文(第7版)/9.6授乳婦の項
A:
電子添文上、高齢者への投与の制限はありません。
【参考情報】
非高齢(18~45歳)及び高齢(65~80歳)の健康成人36例にフィネレノン錠10mg注)を単回経口投与したとき、高齢者では非高齢者と比較して、フィネレノンのAUCは34%増加、Cmaxは51%上昇しました。しかし、投与量及び体重で標準化したAUCnorm及びCmax,normはそれぞれ27%増加及び43%上昇であったことから、年齢による曝露量の差は体重差が寄与していることが示唆されました。[1]
注)ケレンディア錠の承認された用法及び用量は以下のとおりです。[2]
<2型糖尿病を合併する慢性腎臓病>
通常、成人にはフィネレノンとして以下の用量を1日1回経口投与する。
eGFRが60mL/min/1.73m2以上:20mg
eGFRが60mL/min/1.73m2未満:10mgから投与を開始し、血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に20mgへ増量する。
<慢性心不全>
通常、成人にはフィネレノンとして以下の用量を1日1回経口投与する。
eGFRが60mL/min/1.73m2以上:20mgから投与を開始し、血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に40mgへ増量する。
eGFRが25mL/min/1.73m2以上 60mL/min/1.73m2 未満:10mgから投与を開始し、血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に20mgへ増量する。
◆◆参考文献◆◆
[1]ケレンディア錠インタビューフォーム(第7版)/Ⅶ.薬物動態に関する項目10.特定の背景を有する患者(3)非高齢及び高齢の健康被験者を対象とした薬物動態試験
[2]ケレンディア錠電子添文(第7版) 6.用法及び用量の項
A:
グレープフルーツを含む食品(グレープフルーツジュースや果肉など)との併用は避けてください。併用により本剤の血中濃度が上昇するおそれがあります。[1]
また、セイヨウオトギリソウ(St. Johnʼs Wort,セント・ジョーンズ・ワート)を含む食品との併用は避けてください。併用により本剤の血中濃度が低下するおそれがあります。[1]
◆◆参考文献◆◆
[1]ケレンディア錠電子添文(第7版)/10.2併用注意の項
A:
電子添文上規制はありませんが、手術前に飲食を制限される場合には体内の水分量の低下により血清カリウム値が上昇するおそれがあるため、本剤を一時的に中止することを考慮してください。[1]
◆◆参考文献◆◆
[1]ケレンディア錠適正使用ガイド
