製品Q&A
製剤に関する項目
A:
分包・一包化したときの製剤の安定性等の試験を実施していないため推奨しません。分包紙で保存したデータはございませんが、参考までに、マスーレッド錠5mg、12.5mg、25mg、75mgを開放容器(ガラス容器又はポリエチレンボトル)に60℃又は40℃/75%RHで1ヵ月保存した苛酷試験において、性状、溶出性、類縁物質、含量等を測定したところ、規格内でした1)。
◆◆参考文献◆◆
1) マスーレッド錠 インタビューフォーム Ⅳ.製剤に関する項目/6.製剤の各種条件下における安定性の項
PP-MOL-JP-0178-07-01
治療
A:
「腎性貧血」です1)。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/4.効能又は効果
PP-MOL-JP-0178-07-01
A:
用法及び用量は以下の通りです。
<保存期慢性腎臓病患者>
赤血球造血刺激因子製剤で未治療の場合
通常、成人にはモリデュスタットとして1回25mgを開始用量とし、1日1回食後に経口投与する。以後は、患者の状態に応じて投与量を適宜増減するが、最高用量は1回200mgとする。
赤血球造血刺激因子製剤から切り替える場合
通常、成人にはモリデュスタットとして1回25mg又は50mgを開始用量とし、1日1回食後に経口投与する。以後は、患者の状態に応じて投与量を適宜増減するが、最高用量は1回200mgとする。
〈透析患者〉
通常、成人にはモリデュスタットとして1回75mgを開始用量とし、1日1回食後に経口投与する。以後は、患者の状態に応じて投与量を適宜増減するが、最高用量は1回200mgとする。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/6.用法及び用量
PP-MOL-JP-0178-07-01
A:
赤血球造血刺激因子製剤未治療の場合、保存期慢性腎臓病患者及び腹膜透析患者では、ヘモグロビン濃度で11g/dL未満、血液透析患者ではヘモグロビン濃度で10g/dL未満を目安に投与を開始してください1)。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/5.効能又は効果に関連する注意
PP-MOL-JP-0178-07-01
A:
投与量の調節については下記の表を参考に1段階ずつ投与量を増減してください1)。

赤血球造血刺激因子製剤で未治療の場合、本剤投与開始4週後は[4週時投与量増減表]を、それ以降は[投与量増減表]を参考に投与量を増減してください。
赤血球造血刺激因子製剤から切り替える場合、[投与量増減表]を参考に投与量を増減してください。
[4週時投与量増減表(赤血球造血刺激因子製剤で未治療の場合)]
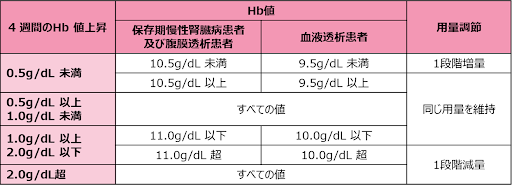
[投与量増減表]


増量は原則として4週間以上の間隔をあけておこなってください。
休薬した場合は1段階低い用量で投与を再開してください。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/7.用法及び用量に関連する注意
PP-MOL-JP-0178-07-01
A:
1日1回食後に服用してください。服用する時間帯の制限はありませんが飲み忘れないことが重要ですので、患者さんの生活スタイルや併用薬の服薬状況などに応じてご判断ください。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/6.用法及び用量
PP-MOL-JP-0178-07-01
A:
多価陽イオンを含有する経口製剤は併用注意に設定されています。両剤を同時に服用した場合、本剤の消化管からの吸収が減少し、血中濃度が低下すると考えられています。多価陽イオンを含有する経口製剤を併用する場合は、前後1時間以上間隔をあけて投与するようにしてください1) 2)。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/10.相互作用
2) マスーレッド錠 電子添文/16.7 薬物相互作用
PP-MOL-JP-0178-07-01
A:
経口鉄製剤は併用注意に設定されています。経口鉄製剤を併用する場合は、前後1時間以上間隔をあけて投与するようにしてください。また、静注鉄製剤については併用注意に設定されていませんので併用は可能です1)2)。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/10.相互作用
2) マスーレッド錠 電子添文/16.7薬物相互作用
PP-MOL-JP-0178-07-01
A:
HMG-CoA還元酵素阻害剤との併用は可能です。マスーレッドの添付文書においてHMG-CoA還元酵素阻害剤は、併用注意に設定されていません1)2)。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/10.相互作用
2) マスーレッド錠 電子添文/16.7薬物相互作用
PP-MOL-JP-0178-07-01
A:
マスーレッド投与開始後は、ヘモグロビン濃度が目標範囲で安定するまでは2週に1回程度、その後は4週に1回程度確認して、必要以上の造血作用があらわれないように十分注意してください1)。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/8.重要な基本的注意
PP-MOL-JP-0178-07-01
A:
飲み忘れた場合は気が付いた時に1回分を服用してください。ただし、次の服用時間が近い場合は1回飛ばしてください。絶対に2回分を一度に服用しないでください1)。
◆◆参考文献◆◆
1) マスーレッド錠 患者向医薬品ガイド
PP-MOL-JP-0178-07-01
薬効薬理・薬物動態
A:
マスーレッドはエリスロポエチン(EPO)の主要な転写因子である低酸素誘導因子(HIF:hypoxia inducible factor)の分解に関わるHIF-プロリン水酸化酵素(HIF-PH)を阻害します。それにより、通常酸素濃度下でHIF-αの分解が抑制されてHIF-αが安定化し、HIF-βと結合してEPO遺伝子の転写が活性化します。その結果、内因性EPOの産生が誘導されることにより、赤血球産生が促進します。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/18.1作用機序
PP-MOL-JP-0178-07-01
A:
マスーレッドは主にUGT1A1によって、薬理学的に不活性なN-グルクロン酸抱合体(代謝物M-1)に代謝され、1)投与量の約3~6%が未変化体として尿中に排泄されます2)。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/16.4代謝
2) マスーレッド錠 電子添文/16.5排泄
PP-MOL-JP-0178-07-01
安全性(特殊患者を含む)
A:
マスーレッドは主に肝臓で代謝されるため、中等度の肝機能障害(Child-Pugh分類B)のある患者さんでは本剤の血中濃度が上昇することが示唆されています。そのため、中等度以上の肝機能障害のある患者さん(Child-Pugh分類BまたはC)への投与は減量を考慮するとともに、患者の状態を慎重に観察してください1)2)。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/9.3肝機能障害患者
2) マスーレッド錠 電子添文/16.6特定の背景を有する患者
PP-MOL-JP-0178-07-01
A:
妊婦又は妊娠している可能性のある女性へのマス―レッドの投与は禁忌です1)。
授乳婦への投与は治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討してください。母動物(ラット)への投与で本剤は乳汁中へ移行することが報告されています2)。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/9.5妊婦
2) マスーレッド錠 電子添文/9.6授乳婦
PP-MOL-JP-0178-07-01
A:
マスーレッドの添付文書において、高齢者に関する注意は設定されていません1)。
非高齢(18~45歳)及び高齢(65~85歳)健康男女被験者に本剤20mgを空腹時に投与したとき、非高齢者と比較して高齢者における本剤のAUC(0-∞)及びCmaxはそれぞれ33%及び39%増加しました2)。
◆◆参考文献◆◆
1) マスーレッド錠 インタビューフォーム/Ⅷ.安全性に関する項目/6.特定の背景を有する患者
2) マスーレッド錠 電子添文/16.6特定の背景を有する患者
PP-MOL-JP-0178-07-01
A:
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していません1)。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/9.7小児等
PP-MOL-JP-0178-07-01
A:
透析患者(血液透析患者、腹膜透析患者及び血液ろ過透析患者)に本剤75mgを透析施行日又は非透析施行日の空腹時に単回経口投与したとき、非透析日に対する透析日の本剤のAUC(0-∞)は血液透析患者で11%、腹膜透析患者で5%、血液ろ過透析患者で2%低下し、Cmaxはそれぞれ28%及び6%低下並びに17%増加であり、透析の影響はわずかでした1)。
◆◆参考文献◆◆
1) マスーレッド錠 電子添文/16.6.2透析の影響
PP-MOL-JP-0178-07-01
