製品Q&A
治療
A:
根治切除不能又は転移性の腎細胞癌、切除不能な肝細胞癌、根治切除不能な甲状腺癌*です1)。
*甲状腺未分化癌患者に対する本剤の有効性及び安全性は確立していません。
◆◆参考文献◆◆
1) ネクサバール錠200mg 電子添文(2025年9月改訂 第6版)
A:
通常、成人にはソラフェニブとして1回400mgを1日2回経口投与します。なお、患者の状態により適宜減量します1)。
※減量基準は、ネクサバール錠200mg 電子添文「7. 用法及び用量に関連する注意」の項を参照してください。
◆◆参考文献◆◆
1) ネクサバール錠200mg 電子添文(2025年9月改訂 第6版)
A:
飲み忘れた場合は、1回分とばして次の服用時間から1回分を飲んでください。絶対に2回分を一度に飲まないでください1)。
◆◆参考文献◆◆
1) ネクサバールくすりのしおり(2025年9月改訂)
A:
高脂肪食の食後に本剤を投与した場合、血漿中濃度が低下するとの報告があます。高脂肪食摂取時には食事の1時間前から食後2時間までの間を避けて服用してください1)。
◆◆参考文献◆◆
1) ネクサバール錠200mg 電子添文(2025年9月改訂 第6版)
A:
一般に高齢者では生理機能が低下していることや副作用発現のリスク因子を有していることが多いため、高齢者にネクサバールを投与する際は、診察や血圧、血液学的検査、生化学検査などの検査を定期的に行い患者の状態を十分に観察しながら特に慎重に投与を行ってください1-3)。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 腎細胞癌編 第12版
2) ネクサバール適正使用ガイド 肝細胞癌編 第10版
3) ネクサバール適正使用ガイド 甲状腺癌編 第6版
A:
創傷の状態を確認し、治癒していることを確認してから投与を行ってください。なお、臨床試験の際には本剤投与開始前4週間以内に大きな手術を行った症例は除外しています1-3)。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 腎細胞癌編 第12版
2) ネクサバール適正使用ガイド 肝細胞癌編 第10版
3) ネクサバール適正使用ガイド 甲状腺癌編 第6版
A:
手術前の休薬期間については、明確な規定はありません。しかし、ネクサバール投与により創傷治癒を遅らせる可能性があるので、手術時は投与を中断することが望ましいです。手術後の投与再開は患者の状態に応じて判断してください1)。
◆◆参考文献◆◆
1) ネクサバール錠200mg 電子添文(2025年9月改訂 第6版)、ネクサバール錠200mg インタビューフォーム(2025年10月改訂 第23版)
薬効薬理・薬物動態
A:
細胞増殖に関与するMAP(Mitogen Activated Protein)キナーゼ・シグナル伝達経路の構成分子であるRAFキナーゼ、ならびにVEGFR(Vascular Endothelial Growth Factor Receptor)などの血管新生に関与する増殖因子の受容体型キナーゼを阻害することにより、腫瘍細胞増殖抑制効果ならびに腫瘍血管新生阻害効果が期待されます1-3)。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 腎細胞癌編 第12版
2) ネクサバール適正使用ガイド 肝細胞癌編 第10版
3) ネクサバール適正使用ガイド 甲状腺癌編 第6版
A:
海外において健康成人を対象としてネクサバールの薬物動態に及ぼす食事の影響を検討した結果、高脂肪食を摂取直後にネクサバールを投与した場合、空腹時投与と比較してネクサバールの血漿中濃度が低下しました。高脂肪食摂取時には、食事の1時間前から食後2時間までの間を避けてネクサバールを服用してください1-3)。
(参考)
食事の影響(外国人における成績)
健康成人15例に、高脂肪食(約900~1,000kcal、脂肪含量50~60%)摂取直後、中脂肪食(約700kcal、脂肪含量30%)摂取直後及び空腹時にネクサバール400mgを単回経口投与した場合、中脂肪食後に投与した際のAUCは、空腹時と比較し14%増加し、高脂肪食後に投与した際は29%低下しました。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 腎細胞癌編 第12版
2) ネクサバール適正使用ガイド 肝細胞癌編 第10版
3) ネクサバール適正使用ガイド 甲状腺癌編 第6版
A:
ヒトでは主としてCYP3A4による酸化的代謝とUGT1A9によるグルクロン酸抱合反応の2経路により代謝されると考えられています1)。
排泄は主に糞中排泄であり、健康成人における14C-ソラフェニブ100mg単回投与後14日目までの総排泄率は、糞中77.1%、尿中19.2%と報告されています1)。
◆◆参考文献◆◆
1) ネクサバール錠200mg 電子添文(2025年9月改訂 第6版)、ネクサバール錠200mg インタビューフォーム(2025年10月改訂 第23版)
A:
併用に注意する薬剤を以下に示します。また、他の抗悪性腫瘍剤との併用については、有効性及び安全性は確立していません1-3)。

※ワルファリンとの併用について
ネクサバールは出血リスクを上昇させる可能性がありますので、ワルファリンを併用する際は、凝固パラメータを定期的に測定し、適宜ワルファリンの用量を調節するなどの対応が望まれます。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 腎細胞癌編 第12版
2) ネクサバール適正使用ガイド 肝細胞癌編 第10版
3) ネクサバール適正使用ガイド 甲状腺癌編 第6版
安全性(特殊患者を含む)
A:
Child-Pugh分類Aの肝細胞癌患者への投与を推奨します1)。
- 劇症肝炎、肝不全、肝機能障害があらわれることがあり、死亡に至る例が報告されています。AST、ALTの上昇を伴う肝機能障害・黄疸、肝不全、肝性脳症などの異常が認められた場合には、減量、休薬、又は投与を中止し、専門医による治療などの適切な処置が必要です。
- 重度の肝障害のある患者への投与は推奨されません。特に投与前のAST、ALTが200IU/Lを超える患者への投与は避けてください。
- 肝細胞癌では肝機能が低下している患者が多いため、注意が必要です。
- 投与初期に肝機能検査値(AST、ALT、T-Bil)が急激に悪化する症例が複数認められています。投与開始から1ヵ月間は週1回、以後3ヵ月までは2週に1回、その後は1ヵ月に1回の頻度で観察・肝機能検査を行うことが推奨されます。
- 主に肝細胞癌又は肝硬変のある患者に肝不全、肝性脳症が報告されているので、これらの症例に投与する際には、血中アンモニア値などの検査を行うとともに、意識障害などの臨床症状を十分に観察してください。
- 低グレード症例のほとんどは投与を継続できますが、AST、ALT、T-Bilの急激な上昇が認められた場合、AST、ALTが200IU/Lを超える場合、T-Bilが3.0mg/dLを超える場合、劇症肝炎の場合はただちに休薬し、適切な処置及び十分な観察を行ってください。
(参考)
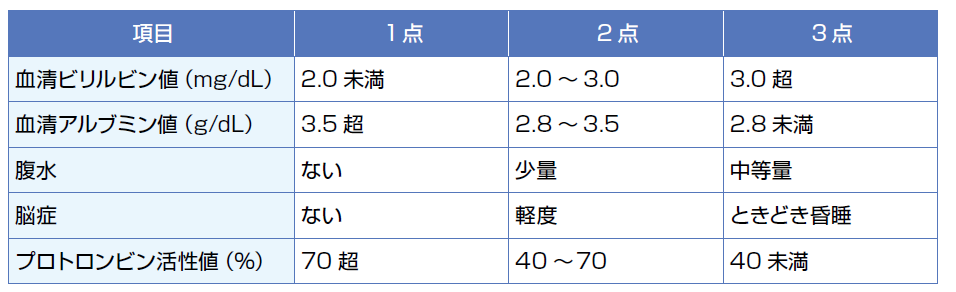
Child-Pugh分類
[各項目のポイントを加算し、その合計点で分類する。Child-Pugh A:5~6点、B:7~9 点、C:10~15点]
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 肝細胞癌編 第10版
A:
- 肝細胞癌患者に対する国内第Ⅰ相試験および海外第Ⅲ相試験において軽度の肝機能障害(Child-Pugh分類A)患者と中等度の肝機能障害(Child-Pugh分類B)患者における副作用の発現頻度に大きな差は見られなかったため、用量調節の必要はないと考えられます。しかし、重度の肝機能障害(Child-Pugh分類C)のある患者への投与は、使用経験がないため推奨されません1,2)。
- 劇症肝炎、肝不全、肝機能障害があらわれることがあり、死亡に至る例が報告されています。AST、ALTの上昇を伴う肝機能障害・黄疸、肝不全、肝性脳症などの異常が認められた場合には、減量、休薬、又は投与を中止し、専門医による治療などの適切な処置が必要です1,2)。
- 低グレード症例のほとんどは投与を継続できますが、AST、ALT、T-Bilの急激な上昇が認められた場合、AST、ALTが200IU/Lを超える場合、T-Bilが3.0mg/dLを超える場合、劇症肝炎の場合はただちに休薬し、適切な処置及び十分な観察を行ってください1,2)。
- 投与開始から3ヵ月間は2週間隔、その後は1ヵ月に1度、肝機能検査の実施が望まれます(注:肝硬変を合併した患者では投与開始から1ヵ月間は1週間隔の検査の実施が望まれます)1,2)。
- 肝硬変を合併した患者に肝性脳症が報告されているので、これらの症例に投与する際には、血中アンモニア値などの検査を行うとともに、意識障害などの臨床症状を十分に観察してください1,2)。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 腎細胞癌編 第12版
2) ネクサバール適正使用ガイド 甲状腺癌編 第6版
A:
ネクサバールの薬物動態に及ぼす腎機能の影響を評価する海外第Ⅰ相試験において、軽度の腎機能障害(Ccr50~80mL/min)、中等度の腎機能障害(Ccr30~<50mL/min)及び、重度の腎機能障害(Ccr<30mL/min)を有する被験者に、ネクサバール400mgを単回経口投与した場合、腎機能低下によるネクサバールの薬物動態への影響はみられませんでした。しかし、腎機能障害患者における連日投与による副作用発現への検討は行われていないため、十分な注意が必要と考えられます。なお、透析患者に対する有効性、安全性は確立していないため、現時点では投与は推奨できません。また、中等度の腎機能障害のある患者においては、忍容性が低いとする海外での報告があります1-3)。 (下記参照)
(参考)
腎機能障害及び肝機能障害のある患者を対象とした、医師主導型海外第Ⅰ相試験( 海外:Miller AA et al.: J Clin Oncol 27(11);1800-1805, 2009)においては、同様に薬物動態への有意な影響はみられなかったものの、薬力学的見地において忍容性が低いことから、中等度以上の腎機能障害のある患者(Ccr<40mL/min)では、半量に減量して投与を開始することが推奨されています。ただし、減量投与時の有効性に関しては確立していないため、患者の状態を勘案して忍容性があると判断された場合には、増量することも考慮してください。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 腎細胞癌編 第12版
2) ネクサバール適正使用ガイド 肝細胞癌編 第10版
3) ネクサバール適正使用ガイド 甲状腺癌編 第6版
A:
透析患者に対する有効性、安全性は確立していないため、推奨できません1-3)。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 腎細胞癌編 第12版
2) ネクサバール適正使用ガイド 肝細胞癌編 第10版
3) ネクサバール適正使用ガイド 甲状腺癌編 第6版
A:
妊婦又は妊娠している可能性のある女性には投与しないでください(禁忌)。また、妊娠可能な女性に対しては、投与中及び投与中止後少なくとも2週間は有効な避妊を行うよう指導してください。また、授乳婦への投与については、授乳しないことが望ましいです1)。
◆◆参考文献◆◆
1) ネクサバール錠200mg 電子添文(2025年9月改訂 第6版)、ネクサバール錠200mg インタビューフォーム(2025年10月改訂 第23版)
A:
腎細胞癌に対する国内外の臨床試験では、収縮期血圧で9.1~11.0mmHg、拡張期血圧で6.9~7.4mmHgの血圧上昇が認められました1-3)。

◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 腎細胞癌編 第12版
2) ネクサバール適正使用ガイド 肝細胞癌編 第10版
3) ネクサバール適正使用ガイド 甲状腺癌編 第6版
A:
まず、胸部X線、胸部CTによる評価を行ってください。なお、高解像度CT (HRCT) がより推奨されます。すりガラス状陰影や、間質性肺疾患を疑わせる他の所見が認められた場合は、速やかに本剤の投与を中止し、感染症、心不全、血栓塞栓症などの鑑別診断をすすめてください。また治療については、呼吸器専門医の指示に従い、ステロイド投与などの適切な処置を行ってください。治療開始前にKL-6、SP-D、SP-Aなど、間質性肺炎マーカーを採取しておくと診断・フォローアップに役立ちます1-3)。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 腎細胞癌編 第12版
2) ネクサバール適正使用ガイド 肝細胞癌編 第10版
3) ネクサバール適正使用ガイド 甲状腺癌編 第6版
A:
現時点までに得られている情報からは、腎細胞癌と肝細胞癌で副作用のプロファイルは大きく異なるものではなく、腎細胞癌の特定使用成績調査などで報告された有害事象は肝細胞癌においても同様に注意すべきであると考えられます。しかし、投与初期に肝機能検査値(AST、ALT、T-Bil)が急激に悪化する症例が認められることから、投与開始後1ヵ月間は、週1回の頻度での観察・検査を推奨いたします。 また、肝細胞癌では、他の癌腫と比較して肝障害を呈している患者割合が高いことや、食道静脈瘤などからの出血が起こりやすい状態であることなど、肝細胞癌の病態に関連する有害事象についても注意が必要だと考えられます1)。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 肝細胞癌編 第10版
その他
A:
腎細胞癌の臨床試験に組み入れられ有効性評価の対象となったのは主に、Motzer分類の低リスクおよび中等度リスクの患者だったため、高リスク群の患者における有効性・安全性は確立していません1)。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 腎細胞癌編 第12版
A:
肝細胞癌における他の抗悪性腫瘍剤との併用は検討されておらず、有効性、安全性は確立されていないため、推奨できません1)。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 肝細胞癌編 第10版
A:
肝細胞癌に対する海外第Ⅲ相試験において、ネクサバール投与群では299例中116例で、肝細胞癌に対する治療歴として、局所療法(肝動脈化学塞栓療法、経皮エタノール注入療法、ラジオ波熱凝固療法)が施行されています。本試験では「局所療法はベースラインにおける撮像より少なくとも4週間前までに完了」する規定となっていました1)。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 肝細胞癌編 第10版
A:
本剤治療後の局所療法(経皮的エタノール注入療法、ラジオ波熱凝固療法、マイクロ波凝固療法、肝動脈塞栓療法/肝動脈化学塞栓療法、放射線療法など)の施行は検討されておらず、有効性、安全性は確立していません1)。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 肝細胞癌編 第10版
A:
国際共同第Ⅲ相試験における対象被験者の組織型として、以下の規定を選択基準として設けていました1)。
①分化型甲状腺癌(乳頭癌、濾胞癌、Hürthle細胞癌)
②低分化癌並びにその他分化型甲状腺の異型癌(例:甲状腺島状癌、tall cell variantなど)
であり、組織診で髄様癌及び未分化癌の所見が認められない患者。
◆◆参考文献◆◆
1) ネクサバール適正使用ガイド 甲状腺癌編 第6版
