製品Q&A
製剤に関する項目
A:
製剤の安定性試験では、PTP包装で25℃・60%RHで36ヵ月規格内、ポリエチレン容器(閉栓)で60℃で3ヵ月まで規格内、ポリエチレン容器(開放)で40℃・75%RHで3ヵ月規格内でした。1)
(参考情報)
自動錠剤分包機を用いて一包化した時の薬剤の状態を検討したデータがあります。2)
試験開始まで気密保存または高湿度条件下(25℃/75%RH)で3ヵ月保存し吸湿させたベリキューボ錠2.5mg、5mg、10mgについて、自動錠剤分包機2機種(タカゾノ製 Eser HP-128HS-GP、湯山製作所製 PROUD)で一包化し、その際のカセット内詰まり・異音等と錠剤の割れ・欠け等の破損を評価した結果、いずれの保管条件でもカセット内での錠剤の詰まり・異音等はなく、一包化の過程で錠剤の割れ・欠け等は認められませんでした。
なお、すべての分包機や保存条件を保証するものではない点にはご留意ください。
◆◆参考文献◆◆
1) ベリキューボ錠インタビューフォーム【第6版】 P.8
2) ベリキューボ錠インタビューフォーム【第6版】 P.10
治療
A:
「効能又は効果」は、「慢性心不全ただし、慢性心不全の標準的な治療を受けている患者に限る。」です。1)
なお、左室駆出率の保たれた慢性心不全における本剤の有効性及び安全性は確立していないため、左室駆出率の低下した慢性心不全患者に投与してください。
(参考情報)
電子添文
5.効能又は効果に関連する注意
5.1左室駆出率の保たれた慢性心不全における本剤の有効性及び安全性は確立していないため、左室駆出率の低下した慢性心不全患者に投与すること。
5.2「臨床成績」の項の内容を熟知し、臨床試験に組み入れられた患者の背景(前治療、左室駆出率、収縮期血圧等)を十分に理解した上で、適応患者を選択すること。
◆◆参考文献◆◆
1) ベリキューボ錠電子添文【第3版】/4.効能又は効果、5.効能又は効果に関連する注意の項
A:
「用法及び用量」は、「通常、成人にはベルイシグアトとして、1回2.5mgを1日1回食後経口投与から開始し、2週間間隔で1回投与量を5mg及び10mgに段階的に増量する。なお、血圧等患者の状態に応じて適宜減量する。」です。1)
(参考情報)
電子添文
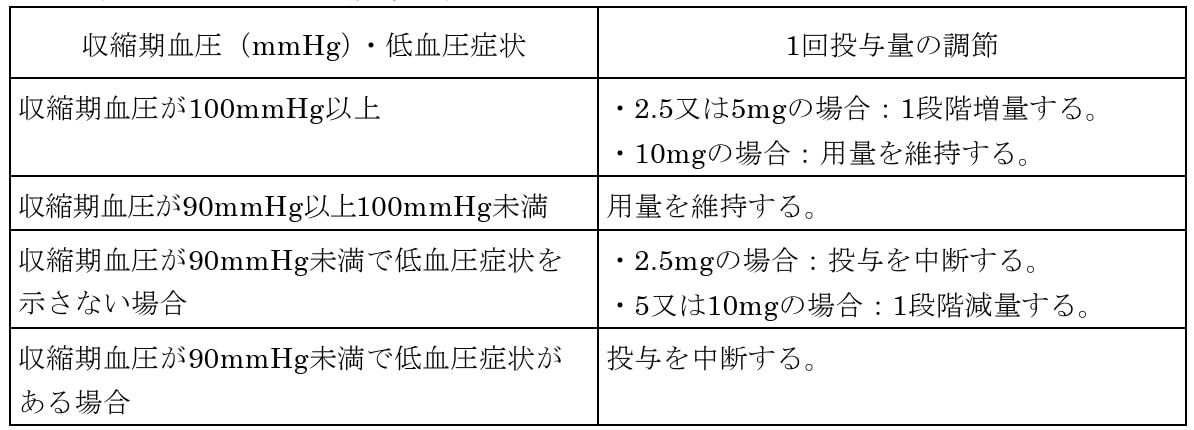
7.用法及び用量に関連する注意
定期的に血圧測定を行い、臨床試験で用いられた以下の基準を参考に本剤の用量を調節すること。
臨床試験で用いられた用量調節基準
◆◆参考文献◆◆
1) ベリキューボ錠電子添文【第3版】 /6.用法及び用量、7.用法及び用量に関連する注意の項
A:
・決して2回分を一度に飲まないでください。
・気がついた時に、1回分を飲んでください。ただし、次の飲む時間が近い場合は1回とばして、次の時間に1回分を飲んでください。1)
◆◆参考文献◆◆
1) ベリキューボ錠患者向医薬品ガイド
A:
1日1回食後に服用してください。1) 服用する時間帯の制限はありませんが飲み忘れないことが重要ですので、患者さんの生活スタイルや併用薬の服薬状況などに応じてご判断ください。
◆◆参考文献◆◆
1) ベリキューボ錠電子添文【第3版】/6. 用法及び用量の項
A:
ベリキューボ錠は慢性心不全患者の増悪を抑制し、予後を改善するための薬剤であるため、明確な効果発現時期を定義できません。
薬効薬理・薬物動態
A:
ベリキューボ錠の有効成分であるベルイシグアトは、選択的かつ特異的に可溶性グアニル酸シクラーゼ(sGC)に結合し、sGCを直接刺激する作用と、内因性NOに対するsGCの感受性を高める2つの作用機序により、濃度依存的にcGMPの産生を増加させます。1)

◆◆参考文献◆◆
1) ベリキューボ錠インタビューフォーム【第6版】P.29
A:
ベリキューボ錠は、主としてグルクロン酸抱合で代謝されます。CYPによる酸化は主要な代謝経路ではありません。
排泄経路は、尿中排泄が約53%、糞中排泄が約45%です。1)
(参考情報)2)
ベリキューボ錠の有効成分であるベルイシグアトは、主に肝臓および腎臓において、UGT1A9、UGT1A1で代謝されます。
CYP による酸化代謝の寄与はわずか(<5%)です。
◆◆参考文献◆◆
1) ベリキューボ錠電子添文【第3版】/16.薬物動態 16.4 代謝の項
2) ベリキューボ錠インタビューフォーム【第6版】P.43-44
A:
ベリキューボ錠は食事の影響を受けます。
本剤を食後投与した場合、空腹時投与と比較して薬剤への曝露量が増加し、薬物動態パラメータの個体間変動の程度は減少しました。1) 2)
そのため本剤は食後投与を推奨しています。
◆◆参考文献◆◆
1) ベリキューボ錠電子添文【第3版】/16.薬物動態 16.2.2 食事の影響の項
2) ベリキューボ錠インタビューフォーム【第6版】P.35-36
安全性(特殊患者を含む)
A:
本剤の血中濃度が上昇するおそれがあるため、重度(Child-Pugh分類C)の肝機能障害がある患者さんにベリキューボ錠を投与する際には、投与の可否を慎重に判断し、投与する場合には患者さんの状態を十分に観察してください。1) 2)
それ以外の肝機能障害患者さんに対しては、電子添文上の制限はありません。
◆◆参考文献◆◆
1) ベリキューボ錠電子添文【第3版】/9. 特定の背景を有する患者に関する注意 9.3肝機能障害患者および 16. 薬物動態の項
2) ベリキューボ錠インタビューフォーム【第6版】P.45
A:
本剤の血中濃度が上昇するおそれがあるため、投与前のeGFRが15mL/min/1.73m²未満又は透析中の患者さんにベリキューボ錠を投与する際には、投与の可否を慎重に判断し、投与する場合には患者さんの状態を十分に観察してください。1) 2)
eGFRが15mL/min/1.73m²以上の腎機能患者さんに対しては、電子添文上の制限はありません。
◆◆参考文献◆◆
1) ベリキューボ錠電子添文【第3版】 9. 特定の背景を有する患者に関する注意 9.2 腎機能障害患者および16.薬物動態の項
2) ベリキューボ錠インタビューフォーム【第6版】P.45
A:
小児等を対象とした臨床試験は実施していません。1)
小児に対する有効性・安全性は不明です。
◆◆参考文献◆◆
1) ベリキューボ錠電子添文【第3版】/9. 特定の背景を有する患者に関する注意 9.7 小児等の項
A:
電子添文上、高齢者への投与の制限はありません。
(参考情報)
非高齢(45歳以下)及び高齢(65歳以上)の健康成人42名に本剤5mgを食後に単回経口投与したとき、非高齢者と比較して、高齢者の薬物動態に関する項目に、臨床的に意味のある年齢の影響はみられませんでした。1)
◆◆参考文献◆◆
1) ベリキューボ錠インタビューフォーム【第6版】P.46
A:
妊婦又は妊娠している可能性のある女性には投与しないことが望ましいとしています。1) ウサギにおける流産及び全胚吸収がヒトの6倍以上の全身曝露量で、ラットにおける出生児の死亡率の増加及び体重増加抑制がそれぞれヒトの49倍及び21倍以上の全身曝露量で報告されています。
授乳中の女性には、治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止をご検討ください。2) 動物実験(ラット、静脈内投与)で乳汁中に移行することが報告されています。
◆◆参考文献◆◆
1) ベリキューボ錠電子添文【第3版】/9. 特定の背景を有する患者に関する注意 9.5 妊婦の項
2) ベリキューボ錠電子添文【第3版】/9. 特定の背景を有する患者に関する注意 9.6 授乳婦の項
A:
併用禁忌は可溶性グアニル酸シクラーゼ(sGC)刺激薬のリオシグアト(アデムパス)です。
ベリキューボと同様に細胞内cGMP濃度を上昇させる作用があるため、降圧作用を増強し、症候性低血圧を起こすおそれがあります。
併用注意はPDE5阻害剤(シルデナフィルクエン酸塩等)、硝酸剤及びNO供与体(ニトログリセリン、亜硝酸アミル、硝酸イソソルビド、ニコランジル等)です。
PDE5阻害薬も細胞内cGMP濃度を上昇させる作用があるため、症候性低血圧を起こすおそれがあります。治療上の有益性と危険性を十分に考慮し、治療上やむを得ないと判断された場合にのみ併用ください。
硝酸剤及びNO供与体も細胞内cGMP濃度を上昇させる作用があるため、症候性低血圧を起こすおそれがあります。
血圧等患者の状態を継続的に観察しながら慎重に投与ください。
◆◆参考文献◆◆
1) ベリキューボ錠電子添文【第3版】/10. 相互作用 10.1 併用禁忌(併用しないこと)および10.2 併用注意(併用に注意すること)の項
A:
電子添文上規制はありません。患者さんの状態等を確認し、個別にご判断ください。
A:
電子添文上制限はありません。患者さんの状態等を確認し、個別にご判断ください。
